「 リコード法では ApoE4の遺伝子保有者は飽和脂肪酸は摂ってはいけないとされている。」
「だからApoE4保有者はココナッツオイルやMCTオイルを控えた方が良い」
軽度認知障害(MCI)や認知症に取り組まれている方から何度となく受けた質問です。
この主張は条件によっては正しくもあり、間違いでもあるので、その理由を書いてみようと思います。
ApoE4とは、リコード法とは
ApoE、アポリポプロティンは脳ではアストロサイトと呼ばれる細胞で作られます。
血液脳関門はコレステロールを通過させないため、脳はコレステロールを自ら作り出しています。
ApoEはコレステロールをニューロンに運ぶための橋を作ります(5)。
そして、ApoE4保有者の場合、インスリン抵抗が高くなると、この橋の上の運搬が特に遅くなるのです。
ApoE4とは認知症発症を強力に予測するタンパク質、もしくはそれを作る遺伝子を指して使われます。
ApoE4を一つ保有している人はアルツハイマー型認知症リスクが3倍、二つ保有している方は8倍に上昇します。確かに強烈な予測遺伝子ですね (1)。
ApoE4を認知症リスクと関連して理解している方のほとんどは、このApoE4を遺伝子の欠陥のように見ているのではないでしょうか。
今回はその誤解をまず解きたいと思います。
次に、リコード法です。ReCODEとはReversal of Cognitive Decline、つまり「認知機能低下の回復」という意味があります。
米国の神経医、Dr. デール・ブレデセンによる認知症治療プロトコルです。
ライフスタイル改善を中心としたリコード法は統合的医療的内容で、一般的な読み物としては日本語でも書籍「アルツハイマー病 真実と終焉」にまとめられています。論文は敷居が高いと思われている方にはお勧めです。https://amzn.to/3p7A6g1

この本でも書かれているように、アルツハイマーは予防できることは真実です。しかし、終焉はしません。
それはメインストリームの人達はこの本を読まないし、読んでもライフスタイルは習慣ですので、ほとんどの人は自分で変革することは難しいからです。
ココナッツオイルやMCTオイルもこの本でも奨励されていますが、ApoE4を持っている人は飽和脂肪酸やこれを多く含むココナッツオイル、MCTオイルは控えるようにと書かれています。
“Both MCT oil and coconut oil, along with the fasting, low-carbohydrate diet, and exercise, will help create mild ketosis. But both may also have drawbacks for ApoE4-positive individuals, as I’ll discuss in greater detail below, so if you are ApoE4-positive, think of MCT and coconut oil as temporary crutches to ease your segue onto fat -burning mode. “
”One approach, used successfully by some members of the website ApoE4.info, is to use MCT oil until you restore your insulin sensitivity. Then, since MCT oil is saturated fat and therefore on the “eat less” list for those with ApoE4, switch over to polyunsaturated fatty acids such as those in olive oil and other cold-pressed oils, or monosaturated fatty acids such as those in nuts. “
Dr. ブレデセンはApoE4保有者は、MCTオイルやココナッツオイルは飽和脂肪酸であるため、ケトーシスへの足掛かりとして使う程度にインスリン感受性が回復するまでの一時的な使用のみ奨励しています。
この主張の根拠となっている、ApoE4と飽和脂肪酸の論文を参照しながら、これがいかに正しいのか、もしくは的外れなのかを説明します。
ApoE4はなぜApoE2やE3よりもリスクが高いのか
現代人のApoE4保有者の多くは、この遺伝子のせいでアルツハイマー発症リスクが高くなるので悲観したり不幸を感じるのではないでしょうか?
ApoE4を遺伝上の欠陥としてみてしまうからですが、ApoE4は欠陥ではなく、人類本来の遺伝子なのです。
書籍の精読だけでリコード法を勉強している人は、こちらのブレデセンのApoE4に関するプレゼンを観てみるとよいでしょう。スライドを見るだけでも勉強になります。
https://www.youtube.com/watch?v=s86wpaF-7XI
700万年の人類史の中で、私達はそのほとんどをApoE4で生存してきました。ApoE3への変異が起こったのは22万年前、ApoE2への変異が起こったのは8万年前なのです(2)。
ApoE4はプライマル(原始)遺伝子
進化人類学的にApoE4は原始的な人類本来の遺伝子であることを理解しました。
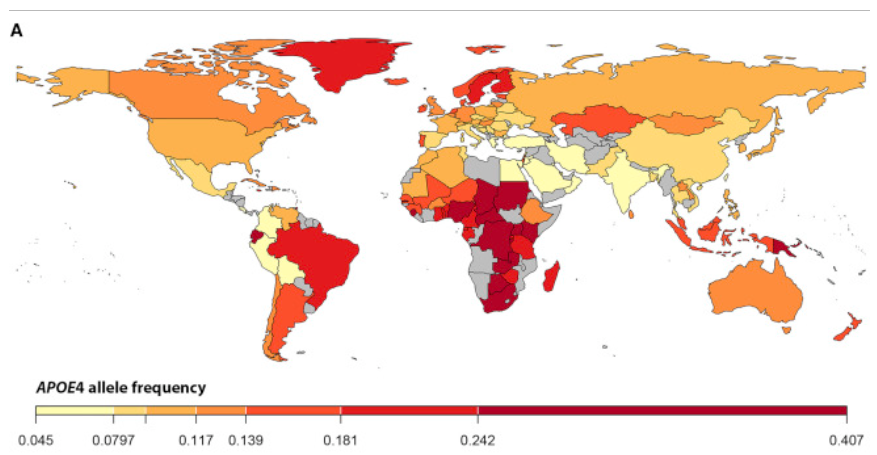
今度はApoE4の発生率を現在の国家や民族別で見ていきましょう。
こちらは国家別のApoE4発生率です。統計がとれていない国もありますが、傾向は隣接する国家や民族から把握できます(3)。
ApoE4は脂質代謝に広範に影響を及ぼす遺伝子です
人類史の97%はApoE4のみを保有していました。しかし、現在に至るまでにE3が人口の大半を占有するようになりました。
私は旧石器時代から新石器時代の農耕生活への移行までの生活様式をまとめて「プライマル」と呼んでいます。
ApoE4はプライマルな遺伝子なのですね。
ApoE3は農耕適応遺伝子
地域別のApoE4の平均値です。
中央アフリカ:40%
オセアニア:37%
オーストラリア:26%
アジア:~25%
世界のApoE4の発生率を見ながらわかることは、農耕社会文化が早い時期に高度に発達した社会/民族ではApoE4の発生率が低いですね。
ApoE4人口が農耕社会への移行により穀物デンプンが主食となり、代謝障害を起こす人が多くなったのでしょう。
そこで糖に対する耐性が比較的高いApoE3を持つ人達が選択されていったのですね。
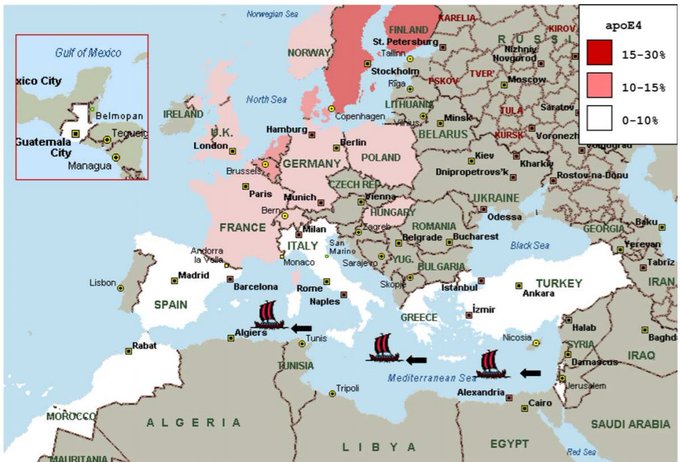
世界最古の文明と言われる地中海沿岸のメソポタミア文明、エジプト文明の民族であるイスラエルやアラブ人は、世界で最もApoE4保有率が低い民族です(4)。
この地域の人口は最も農耕食による選択圧を受けた民族であると考えられます。
ギリシャ人:6.8%
トルコ人:7.9%
イスラエル&アラブ:4%
色分けされた地図でみると一目瞭然ですね。
対照的に農耕に大きく依存してこなかった狩猟採集民族ではApoE4の比率はとても高いですね。植物食を食べることで糖代謝障害による選択圧が少なかったと考えられます。
ピグミー:40.7%
パプア人:36.8%
イヌイット:21.4%
ここまでのまとめです。
ApoE4保有者は原始人と同じように脂質代謝が得意なプライマル遺伝子、ApoE3やE2保有者は糖に対する耐性が比較的高い農耕遺伝子です。
ご先祖様がどこで暮らしてきたのか、によって、その人のApoE4保有率が変わり、糖をどれだけ許容できるのかに影響を与えるのです。
飽和脂肪酸と糖を一緒に摂ると代謝障害リスクが高まります。
ApoE4では糖に対する耐性が低いので、代謝障害リスクはさらに高まります。
つまり、糖質を多く摂取するという前提では、ApoE4は飽和脂肪酸摂取リスクが高まるのです。
糖代謝では認知症リスクが高まるApoE4ですが、脂質代謝はApoE4が栄えた頃の本来の代謝ですので、リスクは逆に減ると考えるのが妥当です。
脂質代謝を行ってる人は非常に少ないので、研究による検証は難しいでしょう。
エビデンスでの検証が難しいからダメ、という思考の停止ではなく、違うアプローチから考えるのが健全ではないでしょうか。
進化人類学からの観点からはプライマルなライフスタイルを導入すれば、ApoE4保有者も認知症予防ができると考えられます。
Dr. ブレデセンの「ApoE4は 飽和脂肪 を控えなさい」の根拠
Dr. ブレデセンの飽和脂肪酸とApoE4の不和に関する主張は、ApoE4.infoに掲載されている情報に基づいていると書籍で示されています。
https://bit.ly/3LOUb4H
https://bit.ly/33H7wL3
こちらで展開されているApoE4と飽和脂肪酸のリスクに関しては2つの疫学調査と1つのレビュー研究からの主張がまとめられています。
Fat intake at midlife and risk of dementia and Alzheimer’s disease: a population-based study
Dietary fats and the risk of incident Alzheimer disease
Saturated and trans fats and dementia: a systematic review
これらの研究の結論をまとめると次の2点です。
→ApoE4には (もしくはApoE2,E3にも) 飽和脂肪酸は悪い
→ApoE4は多価不飽和脂肪酸がよい
と、これまでの旧栄養学的な内容ですね。
これらの研究を飽和脂肪酸リスクを支持する根拠として使うには大きな問題があります。
それは、ほぼすべての研究対象人口は標準食、つまり高糖質低脂質な食事をしているからです。
食事における糖と脂質の組み合わせは良くないことは共通認識であり、Dr. ブレデセンも先に紹介したセミナーの中でそれは認めています。
ApoE4はプライマル(原始)遺伝子なので、ApoE3やE2よりも糖代謝が苦手です。
つまり、糖と脂質の組み合わせの悪影響を強く受けやすいということです。
では、ApoE4保有者がプライマルな食事である旧石器時代食、高脂質低糖質食をしていたらどうでしょうか?
残念ながら現代には旧石器時代食を行っている民族はほぼ消滅してしまいましたので、研究による検証が難しいでしょう。
旧石器時代食ではなくとも、ApoE4は原始的な環境に住む人達の認知機能を逆に高めてくれるでしょう。アマゾンの狩猟採集を行うチマネ族の研究ではApoE4を持つ 群の認知機能が有意的に高いことが示されています(7)。
また、ApoE4発生率が高く、脂肪摂取比率も高い狩猟採集民族において、アルツハイマー発生が多かったなどとする、食事が現代化する前の民族誌研究は見たことはありません。
原始生活ではApoE4を持っていることが有利なのですね。これは「ApoE4=欠陥遺伝子」の観方とは大きく異なります。
近代イヌイットやネイティブインディアンが現代食に変わっていくとアルツハイマー発生率は同地域に住んでいる白人よりも高くなります(6)。
ApoE4と現代の高糖質食の相性はよくないからですね。
ApoE4保有者が、進化の中で食べてきた高脂質低糖質な食事を行う中で、飽和脂肪酸をとることでアルツハイマーリスクが高くなるはずがありません。
旧石器時代の私達の祖先は主食は動物食で、摂取脂肪の多くは飽和脂肪だったからです。
ココナッツオイルとMCTオイル
Dr. ブレデセンによる、ApoE4の方はココナッツオイルやMCTオイルは控えよ、という助言は、ここまで話した飽和脂肪酸のApoE4への影響が理由になっています。
しかし、ココナッツオイルやMCTオイルの脂肪酸組成は、研究の中で対象人口が摂っていたバターやラードなどのC14以上の飽和脂肪酸とは性質が異なります。
ココナッツオイルとMCTオイルの、それぞれ60%と100%を占める中鎖脂肪酸はC14以上の飽和脂肪酸とは全く異なる代謝経路をとります。
研究対象者が摂っていた飽和脂肪(ミリスチン酸、パルミチン酸、ステアリン酸)の割合はココナッツオイルでは30%以下、MCTオイルでは0%なのです。
ココナッツオイルやMCTオイルがApoE4の脂質代謝や認知機能に悪影響を与えるという研究は存在せず、バターやラードと同列で扱うのは不適切です。
リコード法の進化人類学的な矛盾
リコード法は36のアルツハイマー発生に貢献している因子(漏れている穴)を塞いでいくことでアルツハイマー発症リスク、重症化リスクを抑制することが可能なプロトコルです。
その因子の一つである食事に関してはケトフレックス(KetoFLEX ) 12/3 と呼ばれる緩いケトジェニック食が採用されています。
これは2つの食事の軸に基づいています。
1)栄養配分
ケトフレックスは、柔軟性の高い代謝を実現するための、緩いケトジェニックを起こす主要栄養素配分と食材ピラミッドを採用しています。
フルーツや繊維の多い野菜を使うため、フルケトジェニックにはなりません。
2)栄養時間
12/3とは1日12時間以内に食べ、就寝3時間前に食べ終わる、断続的ファスティングの事を指しています。
ケトフレックス12/3は一般的な現代食と比較するとはるかに健康的な食事法であることには間違いありません。 その上で、なぜ「最適」ではないかを見ていきます。
「プロトコル」がゆえの問題
問題の一つは、「栄養配分」と「栄養時間」が個人に最適である可能性が低いということです。
ここで問題としてきたApo遺伝子でさえ、E2、E3、E4の3つのバリエーションがあります。
Apo遺伝子以外にも糖代謝能力の個人差を作っている遺伝子はあるでしょう。
人類はこの700万年の間に、菜食→動物食→植物食の導入→農耕穀物の導入→遺伝子組換え・化学物の導入を経験してきました。
スペクトラムで見てみれば、まだ動物食しか食べれない人から農耕食に少し順応している人が存在するのです。
しかし、リコード法の目指している、臨床予備研究で試された、いわゆるエビデンスベースの食事法を出来るだけ多くの人に伝える、という目的では、「一つの食事メソッド」に絞る必要があったといえます。
その条件においては、そのプロトコルの緩さから比較的実践しやすい「ケトフレックス12/3 」は最高の手法でしょう。
実践してもらわなければ結果は0だからですね。
しかし、認知症のようなその症状の幅や深さが多様な疾患に対し、一つのプロトコルで対応するには無理があり、個人ベースでは最適にはならないでしょう。
リコード法はあくまでも入口、つまり入門編で「型」に慣れるには優れたメソッドです。しかし、個別な最適化に関しては、そこからがスタートなのです。
「栄養源食材」の問題
ApoE4が認知症リスクを上昇させる問題は、それがプライマル(原始)遺伝子であり、現代の環境からの刺激とミスマッチしているからです。
「ケトフレックス12/3 」は現代栄養学で奨励されている、高繊維、低デンプン植物や豆類を多用します。
しかし、これらの食材はApoE4人類が栄えた旧石器時代では食べられていなかった食事です。
つまり、栄養配分と栄養時間には配慮していますが、栄養源となる食材は大きくミスマッチしているということです。
これは、人類学以外の研究者の間でも旧石器時代に人類が何を食べていたのかに対する誤解から起こっている問題です。
ApoE4にベストな環境を提供するにはApoE4が栄えていた旧石器時代食を考えていくとよいでしょう。
そこからは、旧石器時代食の主食ともいえる飽和脂肪酸がだめだ、という発想は出てこないはずなのです。
ケトフレックス12/3と飽和脂肪酸
リコード法ではApoE4の飽和脂肪酸リスクが指摘されています。糖質摂取と脂質摂取は相性は良くありません。
高脂質&高糖質食の研究では、飽和脂肪酸の摂取は一貫してに代謝マーカーを悪化させます。逆に高脂質低糖質の研究では一貫して代謝マーカーは改善されます。
ケトフレックスがフルケトジェニックではなく緩いケトジェニックであるため、摂取糖質量によっては高脂質が悪影響をおよぼすリスクは排除できません。
ApoE4しかバリアントがなかった時代で生きていた当時、人類はフルケトジェニックだったのです。
この観点から、ケトフレックス12/3 を実践するApoE4保有者に飽和脂肪酸を勧めないのは一理あります。
しかし、フルケトジェニックを実践するApoE4保有者に対しては、飽和脂肪酸摂取を否定するような理由は、栄養学的にも進化人類学的にも説得力のあるエビデンスは存在しません。
ケトフレックス 12/3の詳細です。
https://www.apollohealthco.com/ketoflex-12-3/
まとめ
ApoE4はプライマル(原始)遺伝子、つまり脂質代謝用の遺伝子です。
高糖質の食事が続くと、飽和脂肪酸を摂取するリスクは他のApoたんぱくよりもアルツハイマーリスクは高まります。
だから、飽和脂肪酸は悪い、ではなく、ApoE4はプライマル(原始)遺伝子なのですから、原始人のような食事を行えばリスクは上昇しないはずなのです。
進化人類学的にも飽和脂肪酸の摂取は、現代標準食のような高糖質食をしていなければ問題ありません。
リコード法は素晴らしいアルツハイマー予防・治療プロトコルです。
広範なライフスタイル要素を統合しており、他に類を見ない予防&治療プロトコルでしょう。
しかし、これは万人に啓蒙しやすい、そして実践しやすい緩めの「プロトコル」であり、必ずしも個人に最適ではあるとは限りません。
特に原始遺伝子であるApoE4保有者にとっては、最適ではない食事法でしょう。
それはケトフレックス12/3がApoE4が栄えた頃のプライマル(原始)食ではないからです。
リコード法では、飽和脂肪酸が良いとは言えないかもしれませんが、プロトコルをパーソナライズし、より旧石器時代の食事に近づけていくことで、ApoE4の飽和脂肪酸リスクはなくなっていくでしょう。
リスクがなくなるどころか、認知力を向上させてくれる可能性もあるでしょう。遺伝子と環境のミスマッチが減少していくからです。
- Front. Aging Neurosci., 11 February 2019 | https://doi.org/10.3389/fnagi.2019.00014
- Trends Neurosci. 2014 May; 37(5): 247–255.
- Neuron Volume 101, Issue 5, 6 March 2019, Pages 820-838
- Med Hypotheses . 2004;62(5):689-700. doi: 10.1016/j.mehy.2003.11.028.
- Molecular Psychiatry volume 11, pages721–736 (2006)
- Innov Aging. 2020; 4(4): igaa038.
- FASEB J. 2017 Apr; 31(4): 1508–1515.
